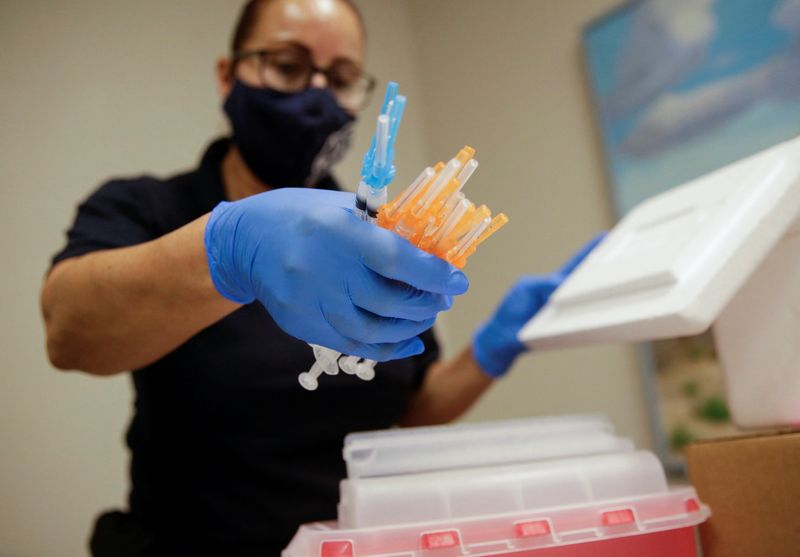
(Reuters) - La Food and Drug Administration (FDA) américaine a autorisé mercredi les nouvelles versions des vaccins contre le COVID-19 de Moderna et de Pfizer/BioNTech, qui ciblent les sous-variants BA.4 et BA.5 Omicron du coronavirus actuellement dominants dans le monde.
L'autorisation des deux vaccins pour une dose de rappel, dès 12 ans pour celui de Pfizer (NYSE:PFE) et 18 ans pour celui de Moderna, doit permettre aux Etats-Unis de lancer une nouvelle campagne de vaccination cet automne.
Ces doses de rappel, qui ciblent également la souche originale du virus, doivent être administrées au moins deux mois après la primo-vaccination ou le rappel le plus récent, précise la FDA dans un communiqué.
Le gouvernement américain s'est procuré 105 millions de doses de Pfizer et 66 millions de doses de Moderna pour tenter d'éviter une explosion des cas de contamination après le début de l'année scolaire et pendant de la saison hivernale.
Pfizer s'est dit prêt à livrer jusqu'à 15 millions de doses d'ici au 9 septembre.
En juin, la FDA avait demandé aux laboratoires d'adapter leurs vaccins contre le COVID-19 aux deux sous-variants les plus actifs ces derniers mois. Le sous-variant BA.5 est responsable de plus de 88% des cas de contamination aux États-Unis.
Les essais cliniques sur l'homme de ces doses de rappels ne sont pas terminés mais la FDA dit fonder sa décision sur les données relatives à la sécurité et à l'efficacité des vaccins originaux ainsi que sur les essais cliniques menés pour les doses de rappel ciblant le sous-variant BA.1 Omicron.
Un comité d'experts indépendants doit se réunir jeudi à l'initiative des Centres américains de contrôle et de prévention des maladies (CDC) afin de fournir des recommandations sur le recours à la nouvelle version des vaccins.
(Reportage Mrinalika Roy à Bangalore ; version française Elitsa Gadeva, édité par Tangi Salaün)